Mini Bioreaktor RTS-1C
RTS-1C zeichnet das Keimwachstum in 50 ml-Röhrchen in Echtzeit auf.
Mit innovativer "Reverse-Spinning-Mischtechnologie":
Drehung der Probe in umgekehrter Richtung um ihre eigene Achse. Diese trägt zu einer hocheffizienten Mischung und Sauerstoffversorgung für die aerobe Kultivierung bei.
In Kombination mit einem optischen Nah-Infrarot-System ist es möglich, die Kinetik des Zellwachstums nicht-invasiv in Echtzeit zu erfassen.
Temperatur-Einstellbereich: +4°C bis +70°C
Angebot anfordernMini-Bioreaktor RTS-1C
- Das Reverse-Spin®-Mischprinzip in 50 ml Falkon-Röhrchen ermöglicht hohe kLa-Werte (h-1) von bis zu 450, die für eine effiziente aerobe Kultivierung unerlässlich sind.
- Individuell gesteuerter Bioreaktor beschleunigt Optimierungsprozesse
- Möglichkeit, mikroaerophile und obligat anaerobe Mikroorganismen zu kultivieren (keine streng anaeroben Bedingungen)
- Reverse-Spin®-Mischprinzip ermöglicht nicht-invasive Biomassemessung in Echtzeit
- Optisches Nahinfrarotsystem ermöglicht die Erfassung der Zellwachstumskinetik
- Software zur Speicherung, Darstellung und Analyse von Daten in Echtzeit
- Kompaktes Design mit geringem Profil und kleiner Stellfläche
- Temperaturkontrolle für Bioprozessanwendungen
- Aktive Kühlung für schnelle Temperaturkontrolle, z.B. für Experimente mit Temperaturschwankungen
- Aufgabenprofilierung für die Prozessautomatisierung
- Cloud-Datenspeicherung zur Fernüberwachung des Kultivierungsprozesses
Typische Anwendungsmethoden
- Echtzeit-Wachstumskinetik der Fermentation
- Screening von Klonkandidaten
- Proteinexpression
- Experimente zu Temperaturstress und -schwankungen
- Medienscreening und -optimierung
- Wachstumscharakterisierung
- Inhibitions- und Toxizitätstests
- Qualitätskontrolle der Stämme
Softwaremerkmale
- Protokollierung des Zellwachstums in Echtzeit
- Grafische 3D-Darstellung der OD oder der Wachstumsrate über Zeit und Einheit
- Pause-Option
- Speichern/Laden-Option
- Bericht-Option: PDF und Excel
- Anschluss von bis zu 10 Geräten an einen PC
- Fernüberwachungsoption (Internetverbindung erforderlich)
- Zyklus-/Profilierungsoptionen
- Möglichkeit der manuellen Kalibrierung für die meisten Zellen
| Bestellnummer RTS-1C | 103.4010 |
| Messbereich | 0–10 OD bei 10-20ml Volumen (0–19 OD λ600 nm äquivalent) 0–8 OD bei 20-30ml Volumen (0–15.2 OD λ600 nm äquivalent) |
| Wellenlänge | 850 nm |
| Messgenauigkeit | ±0.3 OD |
| Lichtquelle | NIR-Lichtdiode |
| Messperiodizität/Stunde | 1 – 60 |
| Kulturmediengröße | 10 – 30 ml |
| Typ der Röhrchen aerobe Kultivierung | 50 ml TubeSpin mit Membranfilter (TubeSpin® Bioreactor 50, TPP®)* |
| Typ der Röhrchen für anaerobe Kultivierung | 50 ml TubeSpin mit Membranfilter (TubeSpin® Bioreactor 50, TPP®)* *es ist auch möglich, andere Herstellertubes des gleichen Typs zu verwenden, z.B. Corning® 50ml Mini-Bioreaktor, aber der Rotor des Gerätes muss modifiziert werden. Bei Bedarf extra Anfragen! |
| Temperatur-Einstellbereich | +4°C ... +70°C |
| Temperatur-Regelbereich | 15°C unter Umgebungstemperatur ... +70°C |
| Stabilität | ±0.1°C |
| Drehzahleinstellbereich | 50 – 2000 U/min |
| Max. Anzahl der an die Software angeschlossenen Geräte | 10 |
| Anzeige | LCD |
| PC-Mindestanforderungen | Intel/AMD Processor, 1 GB RAM Windows Vista/7/8/8.1/10/11, USB 2.0 port |
| Optimale PC-Anforderungen | Intel/AMD Processor, 3 GB RAM Windows Vista/7/8/8.1/10/11, USB 2.0 port |
| Gesamtabmessungen (B x T x H) | 130 × 212 × 200 mm |
| Gewicht | 2,2 kg |
| Eingangsstrom/Stromverbrauch | 12 V DC, 5 A / 60 W |
| Externes Netzgerät | Eingang AC 100-240 V 50/60 Hz, Ausgang DC 12 V |
Warum brauchen wir in der Biotechnologie ein neues Mischprinzip?
Es gibt doch bereits verschiedene Schüttler für Kolben, Einwegbeutel mit Wellenmischtechnik, Falcon Tubes mit durchlässigen Gasmembranen und Bioreaktoren mit unterschiedlichen Mischprinzipien.
Sie haben Recht, es gibt tatsächlich viele Arten von Reaktionsgefäßen und Bioreaktoren, die der Markt für die Kultivierung von Mikroorganismen anbietet, aber wir glauben, dass die RTS-Technologie ihre eigene Nische hat.
Die wichtigste Frage bei der Auswahl einer Bioprozesstechnologie ist, ob sie skalierbar ist. Die Unmöglichkeit einer direkten Übertragung der optimalen Bedingungen von Thermoshakern auf Bioreaktoren wurde zu einem häufigen Problem. Viele Ingenieure sind auf der Suche nach einem Mittelweg, damit die Kultivierung im Bioreaktor so einfach und zugänglich ist wie in Schüttelkolben und damit der Prozess einerseits parallel durchgeführt werden kann und andererseits der Bioprozess skalierbar ist. Geringere Belüftungswerte bei Schüttelkolben im Vergleich zu Bioreaktoren oder, mit anderen Worten, ein geringerer Sauerstoff-Massentransfer in das Kulturmedium erlauben es nicht, so schnell wie möglich hohe Zelldichten wie in Bioreaktoren zu erreichen.
Weist RTS-1 eine höhere Sauerstoffübertragungsrate in das Kulturmedium auf als Schüttelkolben?
Ja, und unter dem Gesichtspunkt seiner Stellung auf dem Markt der Einweg-Bioreaktoren ist dieser intelligente Mini-Bioreaktor RTS-1 einzigartig. Er nimmt eine Zwischenstellung zwischen Schüttelkolbenreaktoren und typischen Bioreaktoren und Laborbioreaktoren ein, obwohl er den Schüttelkolben aufgrund der Möglichkeit der interdependenten Matrixkultivierung ähnlich ist, sorgen hohe kLa-Werte dafür, dass der RTS-1 für weitere Skalierbarkeit besser geeignet ist.
Der Widerspruch zwischen der Umsetzung von Bioprozessen in Schüttelkolben und Bioreaktoren besteht nicht nur in der Unmöglichkeit, die erhaltenen Daten abzugleichen, sondern auch darin, dass das Prinzip der Agitation (Durchmischung zur Maximierung der Interaktion von Reaktanten und Mikroorganismen im Bioreaktor) ganz anders ist. Der Stoffaustausch, einschließlich der Sauerstoffsättigung des Mediums, und die Geschwindigkeit der Bebrütung in einem Schüttelinkubator sind unvergleichlich geringer als im Bioreaktor. Die Bioingenieure der weltweit führenden Unternehmen sind auf der Suche nach einer Zwischenlösung. Es gibt hybride Lösungen wie die Installation des Bioreaktors auf einem Schüttler oder die nicht-invasive Überwachung der Kultivierungsparameter, aber sie sind zum Scheitern verurteilt, weil der wichtigste Parameter des Bioprozesses der Stofftransport ist und der maximale kLa-Wert des Schüttlers 100 h-1 beträgt, während der durchschnittliche kLa-Wert des Bioreaktors 1000 h-1 beträgt.
Der RTS-1-Sauerstoff-Massentransfer in das Brühenmedium beträgt bis zu 200 h-1, und die RTS-Mischtechnologie kann eine Zwischenstufe in der Makroevolution des Bioprozesses einnehmen und aufgrund des hohen kLa-Wertes zwischen Schüttelinkubatoren und Bioreaktoren liegen.
Welche anderen nicht-invasiven Mischprinzipien gibt es heute auf dem Markt?
Biosan stellt die meisten Geräte für nicht-invasives Mischen her, die wiederum für Bioprozesse verwendet werden können. Wir möchten auch ein neues Mischprinzip, das Reverse Spinning, in diese Tabelle aufnehmen. In Zukunft werden wir mehrkanalige RTS-Geräte mit größeren und kleineren Volumina entwickeln. Wir gehen davon aus, dass die Mischtechnologie auf bis zu 20 Liter skaliert und auf 5 ml verkleinert werden kann. Mit der Möglichkeit, wichtige Bioprozessparameter wie pH und pO2 nicht-invasiv zu messen.
Was ist das Mischprinzip der RTS-Technologie?
Der Beginn der Vortex-Typ-Mischung (VTM) und die Tiefe der Vortex-Höhle hängen ab von 1) der Winkelgeschwindigkeit des RS-Reaktors, 2) der Zeit ab Beginn der Rotation des RS-Reaktors, 3) der Viskosität des Wachstumsmediums und 4) der Temperatur. Diese Parameter bestimmen auch die Winkelgeschwindigkeit der rotierenden Vortexschicht (VL) und den Übergangszustand vom Irrotationswirbel (IRV), wenn die Winkelgeschwindigkeit der VL proportional zum Radius ist, zum Rotationswirbel, wenn die Winkelgeschwindigkeit der VL gleich ist und die VL wie eine monolithische Vortexhöhle aussieht, wie unten dargestellt. Die allgemeinen Regeln für VTM-Prozesse lassen sich wie folgt formulieren: Je mehr Zeit seit der Vortexbildung verstrichen ist, desto deutlicher ist der Übergang vom IRV zum RV. Das Konzept der Reverse-Spin (RS)-Mischung basiert auf diesen Annahmen.

Was ist das Messprinzip der Geräte der RTS-Technologie?
Wie groß ist der messbare Bereich der Biomasse in OD600nm-Einheiten?
Die wesentlichen Elemente des RTS-1-Messsystems bestehen, wie unten dargestellt, aus einer Lichtquelle, einem Detektor (Fotodiode) und einem rotierenden Falcon-Tube-Kammer. Das Falcon-Tube wird auf 2000 min-1 beschleunigt, wodurch eine Monoschicht aus Zellsuspension entsteht, die den optischen Weg der Probe verkürzt. Durch die Verkürzung des optischen Weges ist es möglich, Biomasse im Bereich von 0-19 OD600nm bei 10-20ml und 0-15,2 OD600nm bei 10-30ml zu messen.

Dünnschicht erhöht die OD-Messung durch mechanische nicht-invasive Verdünnung.
Welchen Einfluss hat die Intensität der Durchmischung auf den Stoffaustauschkoeffizienten (kLa)?
O2 kLa in das Medium ist ein äußerst wichtiger Indikator, um die möglichen Aussichten von RTS-1 zu bewerten, hohe Wachstumsraten der Biomasse zu erzielen.
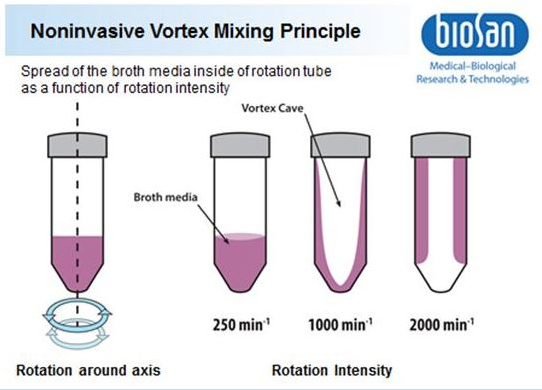
Die Umwälzung des flüssigen Mediums erfolgt durch Vortex Type Mixing (VTM) und Reverse-Spin (RS). Durch die mehrfache Vergrößerung der Kontaktfläche zwischen flüssigem und gasförmigem Medium während der Rotation und die Entstehung von Wellen (siehe Abb. 1) bei der Änderung der Bewegungsrichtung wird die Mischeffizienz sowohl in der flüssigen als auch in der flüssig-gasförmigen Phase erheblich gesteigert. Infolgedessen erfolgt die Sättigung der flüssigen Phase mit Gas und dessen weitere Auflösung darin mit größerer Effizienz als in den meisten Standard-Mischvorrichtungen.
Wie in der Abbildung dargestellt, hängt die Ausbreitung des Brühmediums im Inneren des Röhrchens von der Rotationsintensität ab, die wiederum die Effizienz des VTM und die Geschwindigkeit der O2-Zufuhr beeinflusst.

Warum wir ein neuer Standard für die Trübungsmessung im nahen Infrarot (850 nm) eingeführt und wie lassen sich diese Ergebnisse in die üblichen 600 nm-Wellenlängenwerte umrechnen?
Da es sich um eine nicht-invasive Methode zur Messung der Lichtstreuung in Zellsuspensionen von wachsenden Zellen handelt, ist die Standardisierung des Gefäßes, in dem die Fermentation stattfindet, sehr schwierig. Anstelle einer spektralphotometrischen Küvette und eines Spektralphotometers bieten wir die Verwendung eines Standard Falcon-Röhrchens an, das bei der Kultivierung von Mikroorganismen in den frühen Stadien von Scale-up-Prozessen beliebt ist. Falcon-Röhrchen sind jedoch nicht zu 100 % transparent, und der Grad ihrer Trübung hängt von der Temperatur und der Wellenlänge ab, bei der Sie die Messung durchführen. Aus diesem Grund sind wir auf die Wellenlänge des NIR-Spektrums umgestiegen, um die von der Temperatur abhängigen optischen Eigenschaften des Kunststoffs zu vermeiden.
Wie hoch ist der Umrechnungskoeffizient von 850nm auf 600nm der Werkskalibrierung? Wie wird er berechnet?
Die Werkskalibrierung des Geräts ist für eine spezifische Mikroorganismengröße von 0,4-0,8 x 1-3 μm und ein Zellvolumen von etwa 0,6-0,7 μm3 ausgelegt. Bei Überschreitung der zulässigen Größe wird das Messsystem mit der Werkskalibrierung nicht korrekt funktionieren.
Der Umrechnungskoeffizient von optischer Dichte OD (λ = 850 nm) zu OD (λ = 600 nm) ist gleich 1,9 (Zellen, die für die Messung aus der stationären Phase mit einem Spektralphotometer und einer Küvette mit 1 mm optischem Weg entnommen wurden).
Berechnungsbeispiel: Um 3,5 OD (λ = 850 nm) in OD (λ = 600 nm) umzuwandeln, wird das Ergebnis mit 1,9 multipliziert und ergibt 6,65 OD (λ = 600 nm).
Der Mikroorganismus, der für die Werkskalibrierung verwendet wird, ist E.coli BL21. Die Zellen werden einer Schüttelkolben-Nachtkultur in der stationären Phase des Wachstums entnommen.
Was kann die Messgenauigkeit der Werkskalibrierung beeinflussen?
Während des Wachstumsübergangs der Escherichia coli-Kultur vom exponentiellen Wachstum zur stationären Phase finden eine Reihe von morphologischen und physiologischen Veränderungen statt, einschließlich der Abnahme des Zellvolumens und der Veränderung der Zellform. Wenn Zellen für die Referenzmessung mit dem Spektralphotometer in verschiedenen Stadien der stationären Phase entnommen werden, ist die Genauigkeit der Messung schlechter als angegeben.
Wie beeinflusst die Rotationsintensität die Temperaturgenauigkeit der Probe?
Erstens beeinflusst die Rotationsintensität den Luftstrom, der von außen in das Rohr gelangt. Zweitens beeinflusst die Umgebungstemperatur die im Bioreaktor eingestellte Temperatur und kann daher die Probe abkühlen oder erwärmen. Drittens ist der Kontakt zwischen der Flüssigkeit und dem Falcon Tube-Fach bei höheren Rotationsintensitäten geringer. In der nachstehenden Abbildung sind die Temperaturunterschiede (Δ t°C) zwischen der Röhrenprobe und der eingestellten Thermoblocktemperatur in Abhängigkeit von der aeroben und mikroaerophilen Rotationsintensität bei einer Umgebungstemperatur von 23 °C ± 2 °C und 45 % ± 10 % relativer Luftfeuchtigkeit dargestellt.

Der Temperaturprofilierungsbereich des RTS-1C ist recht hoch, und aufgrund von Taupunkttemperaturen kann Feuchtigkeit auf der optischen Achse des Messsystems auftreten und die Messergebnisse beeinflussen.
Die Genauigkeit der OD-Messung wird durch Feuchtigkeit beeinträchtigt, die aufgrund der Taupunkttemperatur an der Außenwand des Röhrchens auftreten kann. Die relative Luftfeuchtigkeit und die Temperatur beeinflussen den Taupunkt, daher muss die Temperatur des Röhrchens höher sein als die Taupunkttemperatur, damit das Messsystem korrekt funktioniert.
Wie findet man den optimalen Temperaturprofilierungsbereich, um die Taupunkttemperatur zu vermeiden?
Ermitteln der Taupunkttemperatur für den Benutzer.
Suchen Sie die entsprechende Kurve auf dem Bild, die mit der Luftfeuchtigkeit des Raums übereinstimmt, in dem sich das Gerät befindet.
Die horizontale Achse zeigt die Temperatur des Raums an, in dem sich das Gerät befindet.
Verwenden Sie diese Informationen, um eine Projektion auf die vertikale Achse zu erstellen. Der gefundene Punkt auf dem Diagramm ist die Temperatur des Taupunkts.

Wie lässt sich die Taupunkttemperatur bei der Temperaturprofilerstellung vermeiden?
Wenn die Taupunkttemperatur erreicht ist, wird die korrekte Messung des Systems durch Feuchtigkeit gestört. Um Taupunkttemperaturen zu vermeiden, muss der Temperaturunterschied zwischen der Umgebungstemperatur und der Temperatur des Bioreaktors und der Probe verringert werden. Indem der Bioreaktor in eine Umgebungskammer gestellt wird, kann der Temperaturunterschied erheblich verringert werden.
Beispiel für die Berechnung der Temperatur in der Umgebungskammer: Wenn der Bereich der Temperaturprofilierung von +10°C bis +40°C reicht, berechnen Sie die Temperatur der Umgebungskammer: (40-10) / 2 = 15°C.
Ist es möglich, das Gerät in einem Kühlraum oder einer Klimakammer aufzustellen?
Welchen Einfluss hat der Kühlraum auf die Temperaturgenauigkeit des Thermoblocks?
Es ist möglich, das Gerät in einem Kühlraum oder einer Klimakammer aufzustellen, aber die Temperatur des Thermoblocks und die Temperatur der Probe werden in bestimmten Temperaturbereichen nicht genau sein. Temperaturmessungen der Probe und Korrekturen bei maximalen und minimalen Temperaturbereichen oder 4°C-10°C und 60°C-70°C müssen vom Benutzer durchgeführt werden. Sollten weitere Fragen auftauchen, wenden Sie sich bitte direkt an das Biosan RTS-Supportteam, um Unterstützung zu erhalten.
Wie wirkt sich die Temperatur auf die optischen Eigenschaften des Kunststoffs aus?
Wenn sich die Temperatur des Kunststoffs ändert, z. B. bei einem stündlichen Temperaturwechsel von +37 °C auf +10 °C und zurück, ändert das Kunststoffmaterial der Röhre seine optischen Eigenschaften in einem Bereich von ±0,1 OD. Dieser Einfluss ist bei allen Temperaturprofilen zu beobachten, die über 15°C oder mehr liegen.
Wie erstellt man eine Benutzerkalibrierung?
Besorgen Sie sich Zellsuspensionsproben in Falcon-Röhrchen mit typischen optischen Dichten für Ihre Experimente. Wenn die maximale OD Ihres Experiments (stationäre Phase) 5 OD600nm beträgt, dann sind die empfohlenen Proben 0 (ddH2O-Wasser oder Brühe-Medien) 1, 2, 3, 4, 5, 6 OD600nm. Die Volumengenauigkeit der Proben muss ±0,05 betragen.
Die OD bei der gewünschten Wellenlänge jeder Zellsuspension wird mit einem Spektralphotometer gemessen, wobei die Verdünnungen vorher entsprechend angepasst werden. Die Proportionalität zwischen OD und Zelldichte besteht nur für OD ≤ 0,4 (ungefähr), wir empfehlen, die Proben im Bereich von 0,1-0,2 OD zu verdünnen.
Multiplizieren Sie die Werte der Verdünnungsfaktoren, um die OD der Proben zu erhalten.
Fahren Sie mit dem Software-Kalibrierungsmodul fort, das im Software-Handbuch beschrieben ist.